Un àtom és la unitat més petita de matèria que conserva totes les propietats químiques d'un element.
On this page
Introducció
Els àtoms (i les molècules) segueixen les regles de la química i la física tot i que formen part d’un organisme.
Alguns àtoms tendeixen a guanyar o perdre electrons, o formar enllaços entre ells, i això segueix sent cert fins i tot quan els àtoms o molècules formen part d’un organisme viu.
De fet, les interaccions senzilles entre àtoms – dutes a terme moltes vegades i en moltes combinacions diferents en una cèl·lula individual o en un organisme més gran – són les que fan possible la vida.
Entorn de treball
Crea un projecte amb uv
uv init atomImporta la biblioteca periodictable:
cd atomuv add periodictableperiodictable proporciona una taula periòdica dels elements amb suport per a massa, densitat i informació de dispersió de raigs X/neutrons.
La documentació està disponible en línia.
Elements
El terme matèria es refereix a qualsevol cosa que ocupi espai i tingui massa, en altres paraules “allò” del que està fet l’univers.
Tota la matèria està composta de substàncies anomenades elements, que tenen propietats físiques i químiques específiques i que no es poden dividir en altres substàncies per mitjà de reaccions químiques ordinàries. L’or, per exemple, és un element, igual que el carboni.
Cada element es denota amb el símbol químic, que pot ser una sola lletra majúscula o, quan la primera lletra ja està “ocupada” per un altre element, una combinació de dues lletres.
Alguns elements usen el nom en català, com C per al carboni o Ca per al calci. Altres símbols químics provenen dels seus noms en llatí, per exemple, el símbol del sodi és Na, una forma abreujada de natrium, la paraula en llatí per a sodi.
Hi ha 118 elements:
from periodictable import pt
print(len(list(pt.elements)))118Però només els 92 primers ocorren de manera natural.
La resta dels elements han estat creats a laboratoris i són inestables:
from periodictable import pt
for element in list(pt.elements)[99:]: print(element.symbol, end=" ")Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fl Mc Lv Ts OgEls quatre elements comuns a tots els organismes vius són l’oxigen (O), el carboni (C), l’hidrogen (H) i el nitrogen (N), que en conjunt formen al voltant del 96% del cos humà.
Al món no viu, els elements es troben en proporcions diferents i alguns elements que són comuns en els organismes vius són relativament rars a la Terra.
Tots els elements i les reaccions químiques entre aquests obeeixen les mateixes lleis físiques i químiques, sense importar si formen part d’organismes vius o no.
Estructura de l’àtom
Un àtom és la unitat més petita de matèria que conserva totes les propietats químiques d’un element.
Per exemple, una moneda d’or és simplement un gran nombre d’àtoms d’or modelat amb la forma d’una moneda (amb quantitats petites d’altres elements contaminants). Els àtoms d’or no es poden dividir en una mica més petit i conservar-ne les característiques. Un àtom d’or obté les seves propietats de les partícules subatòmiques diminutes de les quals es compon.
Un àtom està compost de dues regions.
-
Una regió petita (el nucli atòmic), que es troba al centre de l’àtom i conté partícules carregades positivament anomenades protons, i partícules neutres, sense càrrega, anomenades neutrons.
-
Una regió molt més gran, formada per un “núvol” d’electrons, partícules de càrrega negativa que orbiten al voltant del nucli.
L’atracció entre els protons de càrrega positiva i els electrons de càrrega negativa és allò que manté unit a l’àtom.
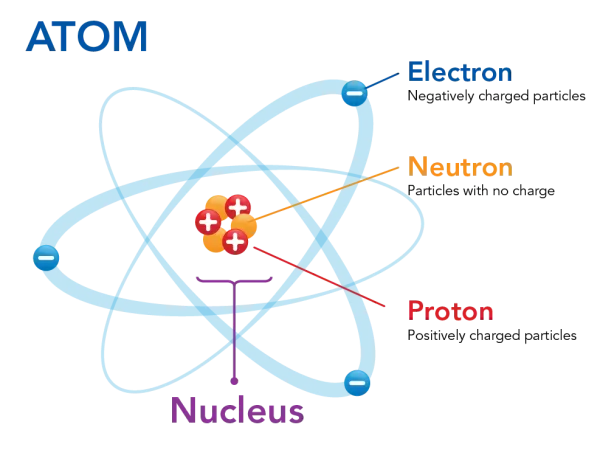
La majoria dels àtoms tenen aquests tres tipus de partícules subatòmiques, protons, electrons i neutrons.
L’hidrogen (H) és una excepció perquè generalment té un protó i un electró, però no té neutrons.
Protons i neutrons
El nombre de protons al nucli defineix quin element és l’àtom
Els protons i neutrons no tenen la mateixa càrrega, però sí que tenen aproximadament la mateixa massa, al voltant d’1.67×10−24 grams.
Atès que els grams no són una unitat de mesura molt convenient per mesurar masses tan petites, els científics van decidir definir una mesura alternativa, el dalton o unitat de massa atòmica (uma).
Un únic protó o neutró té un pes molt proper a 1 uma.
Pots accedir als elements individuals per nom, símbol o nombre atòmic.
import periodictable as pt
print(pt.elements[26])print(pt.elements.Fe)print(pt.elements.symbol('Fe'))print(pt.elements.name('iron'))FeFeFeFePots accedir a un element particular a partir del seu símbol:
element = pt.Cprint(f"{element.symbol} {element.number} {element.mass}")C 6 12.011Mira quina és la massa atòmica dels quatre elements comuns a tots els organismes vius:
life = [pt.H, pt.C, pt.N, pt.O]for element in life: print(f"{element.symbol} {element.number} {element.mass}")H 1 1.008C 6 12.011N 7 14.007O 8 15.999Electrons
El nombre d’electrons que envolta el nucli determina en quin tipus de reaccions pot participar.
Els electrons són molt més petits en massa que els protons, tan sols 1/1800 d’una unitat de massa atòmica, així que no contribueixen gaire a la massa atòmica total de l’element.
Per contra, els electrons tenen un gran efecte a la càrrega de l’àtom, ja que cada electró té una càrrega negativa igual a la càrrega positiva d’un protó. En àtoms neutres, sense càrrega, el nombre d’electrons que orbiten el nucli és igual al nombre de protons dins del nucli. Les càrregues positives i negatives es cancel·len i generen un àtom sense càrrega neta.
Els protons, els neutrons i els electrons són molt petits i la major part del volum d’un àtom — més del 99 % — és en realitat espai buit. Amb tant d’espai buit podries preguntar-te com és que els anomenats objectes sòlids no passen els uns a través dels altres. La resposta és que els núvols d’electrons de càrrega negativa dels àtoms es repel·lirien entre ells si s’aproximessin massa, cosa que dona com a resultat la nostra percepció de la solidesa.
Taula periòdica
Cada element té una posició única a la taula periòdica en funció del nombre de protons, i encara que el símbol ens permet identificar un element de manera natural, el que identica un àtom és precisament el nombre de protons que té.
Específicament, la posició d’un element a la taula periòdica ajuda a conèixer la seva configuració electrònica, la manera com s’organitzen els electrons al voltant del nucli.
Els àtoms usen els seus electrons per participar en reaccions químiques, així que conèixer la configuració electrònica d’un element et permet predir-ne la reactivitat, és a dir, si interactuarà, i de quina manera, amb àtoms d’altres elements.
Dissenyada pel químic rus Dmitri Mendeleev (1834–1907) el 1869, la taula organitza els elements en columnes — grups — i files — períodes — que comparteixen certes propietats. Aquestes propietats determinen l’estat físic d’un element a temperatura ambient – gas, sòlid o líquid –, així com la seva reactivitat química, la capacitat de formar enllaços químics amb altres àtoms.
A més de llistar el nombre atòmic de cada element, la taula periòdica també mostra la massa atòmica relativa de l’element, la mitjana ponderada dels seus isòtops que tenen lloc naturalment a la Terra.
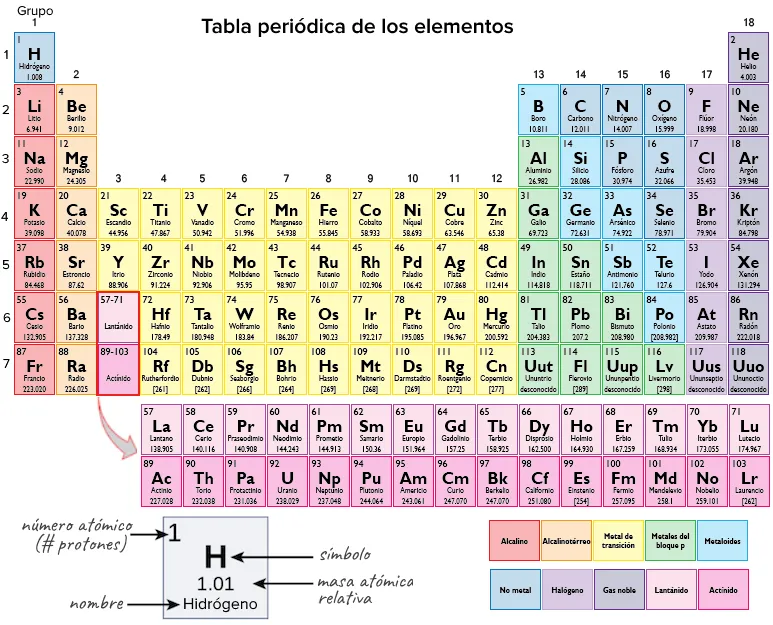
En aquest enllaç tens una taula periòdica més completa: Taula periòdica
Crea un script que demani el número àtomic i mostri la informació principal de l’`atom:
number = int(input("Atomic Number? "))element = pt.elements[number]print(f"{element.name} ({element.symbol}), {element.mass} uma")Crea un script que et demani el simbol (o el nom de l’àtom) i et mostri la informació principal de l’`atom:
target = str(input("Symbol or name? "))
result = Noneif target[0].isupper(): for element in pt.elements: if element.symbol == target: result = element breakelse: for element in pt.elements: if element.name.startswith(target): result = element break
if result: print(f"{result.name} ({result.symbol}), {result.mass} uma")else: print("Not found")Millora l’script per tal de que si hi ha més d’una coincidència amb el nom, et mostri totes les opcions:
Pendent de fer
Enllaços químics
Els éssers vius es componen d’àtoms, però en la majoria dels casos, aquests àtoms no estan flotant individualment.
Per contra, generalment interactuen amb altres àtoms (o grups d’àtoms) mitjançant enllaços químics que mantenen unides a les molècules i creen connexions temporals que són essencials per a la vida.
Aquests enllaços poden ser més forts o més dèbils, i són de 4 tipus diferents: covalent, iònic, d’hidrogen i de dispersió de London.
Per exemple, els àtoms poden estar connectats per enllaços forts i organitzats en molècules o vidres; o poden formar enllaços temporals i febles amb altres àtoms amb què xoquen o freguen.
Tant els enllaços forts que mantenen unides a les molècules com els enllaços més febles que creen connexions temporals són essencials per a la química dels nostres cossos i l’existència de la vida mateixa.
Orbitals de valència
Els atoms formen enllaços perquè intenten assolir l’estat més estable (de menor energia) possible
Molts àtoms esdevenen estables quan:
- El seu orbital de valència és ple d’electrons
- O satisfan la regla de l’octet (en tenir vuit electrons de valència).
Si els àtoms no tenen aquest arranjament, poden guanyar, perdre o compartir electrons mitjançant els enllaços per tal d’aconseguir estar estables.
En aquest apartat veurem amb més detall la taula periòdica, com els àtoms organitzen els electrons i com això ens permet predir la reactivitat dels elements.
És important recordar la valència dels elements més comuns a la vida; perquè aquest defineix el número d’enllaços que pot formar l’element per obtenir estabilitat.
- Hidrogen valencia 1.
- Carboni valencia 4.
- Nitrogen valencia 3.
- Oxigen valencia 2.

Per exemple veiem l’hidrogen, per exemple, apareixen el nom i el símbol H, així com el nombre atòmic d’1 — a la cantonada superior esquerra — i la massa atòmica relativa de 1.01.
Les diferències en la reactivitat química entre els elements es basen en el nombre i la distribució espacial dels seus electrons.
Si dos àtoms tenen patrons d’electrons complementaris, poden reaccionar i formar un enllaç químic, la qual cosa crea una molècula o un compost.**
Exemples de compostos químics comuns són:
- H₂O (aigua) → formada per 2 àtoms d’hidrogen i oxigen.
- CO₂ (diòxid de carboni) → 2 molècules d’oxigen amb una de carboni.
Com veurem a continuació, la taula periòdica organitza els elements de manera que reflecteixin el nombre i el patró d’electrons, cosa que la fa útil per predir la reactivitat d’un element: com de probable és que formi enllaços i amb quins altres elements.
Les capes d’electrons i el model de Bohr
Les capes d’electrons i el model de Bohr
- Bohr (1913) va imaginar l’àtom com un nucli central (protons + neutrons) envoltat per electrons en capes circulars, com planetes al voltant del Sol.
- Cada capa té un nivell d’energia: les més properes al nucli = menys energia; les més llunyanes = més energia.
- A cada capa se li assigna un número
iel símboln: la capa d’electrons més propera al nucli, per exemple, s’anomena1n. - Per saltar de capa, un electró ha d’absorbir o alliberar energia (fotons).
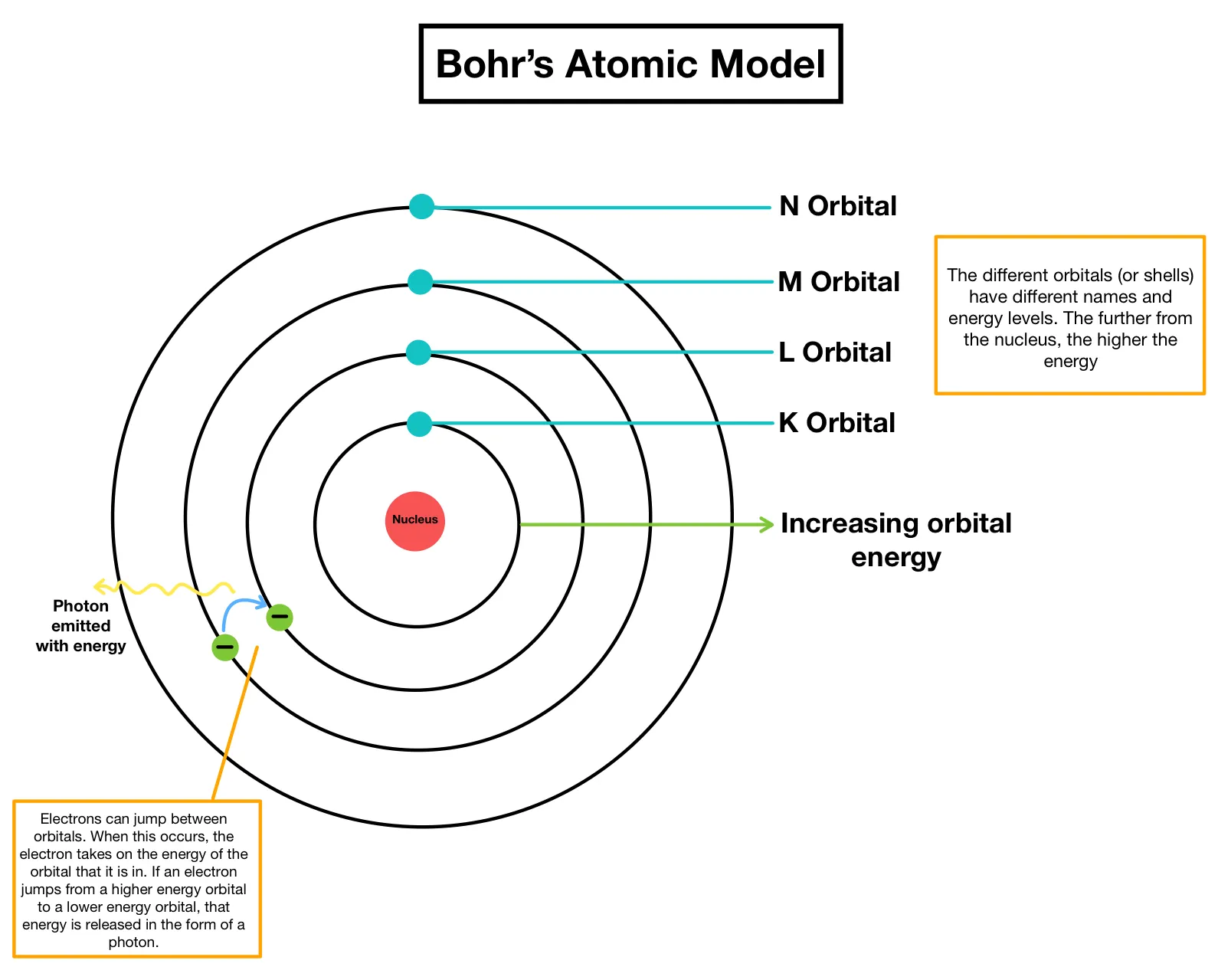
Els àtoms, al estan governats per les lleis de la física, tendeixen a prendre la configuració més estable i de menor energia possible.
Els electrons no es col·loquen de qualsevol manera al voltant del nucli, sinó que segueixen un ordre molt estricte:
- La primera capa (1n) és la més propera al nucli i només pot tenir 2 electrons.
- La segona capa (2n) és una mica més gran i pot arribar fins a 8 electrons.
- La tercera capa (3n) encara és més gran i pot arribar a tenir fins a 18 electrons.
El nombre d’electrons de la capa externa d’un àtom particular determina la seva reactivitat o tendència a formar enllaços químics amb altres àtoms. A aquesta capa externa se’l coneix com a capa de valència i als electrons que es troben dins d’ella se’ls anomena electrons de valència.
En general, els àtoms són més estables, menys reactius, quan la seva capa d’electrons externa es troba completa.
La majoria dels elements importants en la biologia necessiten vuit electrons a la seva capa externa per ser estables i aquesta regla es coneix com a regla de l’octet.
Alguns àtoms poden ser estables amb un octet fins i tot quan la seua capa de valència és la capa 3n que pot contenir fins a 18 electrons. Veurem per què passa això quan expliquem els orbitals atòmics més endavant.
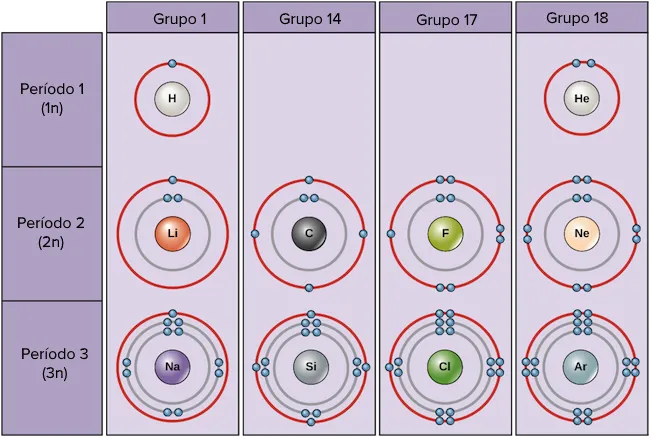
A continuació es mostren exemples d’alguns àtoms neutres i les configuracions electròniques.
En aquesta taula, pots veure que l’heli té una capa de valència completa, amb dos electrons a la primera i única capa, 1n.
De manera similar, el neó té una capa externa 2n completa amb vuit electrons. Aquestes configuracions electròniques fan que l’heli i el neó siguin molt estables.
Configuració electrònica i la taula periòdica
Els elements a la taula periòdica s’ordenen d’acord amb el nombre atòmic (Z), que indica exactament quants protons tenen.
En un àtom neutre, el nombre d’electrons serà igual al nombre de protons, de manera que podem determinar fàcilment el nombre d’electrons a partir del nombre atòmic.
Addicionalment, la posició d’un element a la taula periòdica — la columna o el grup, i la fila o el període — proporciona informació útil sobre com estan disposats els seus electrons.
Si considerem només les primeres tres files de la taula, que inclouen els principals elements importants per a la vida, cada fila correspon a omplir una capa d’electrons diferent: l’heli i l’hidrogen col·loquen els electrons a la capa 1n, mentre que els elements de la segona fila com el Li comencen a omplir la capa 2n i els elements de la tercera fila com el Na continuen amb la capa 3n. De manera similar, el número de columna d’un element ens dona informació sobre el nombre d’electrons de valència i la reactivitat.
En general, el nombre d’electrons de valència és el mateix dins una columna i augmenta d’esquerra a dreta dins una fila. Els elements del grup 1 tenen només un electró de valència i els del grup 18 en tenen vuit, excepte l’heli, que només té dos electrons en total. D’aquesta manera, el número de grup pot predir que tan reactiu serà cada element:
-
L’heli (He), el neó (Ne) i l’argó (Ar), com a elements del grup 18, tenen la capa externa completa o satisfan la regla de l’octet. Això els fa molt estables com a àtoms individuals. A causa de la seva manca de reactivitat són anomenats gasos inerts o gasos nobles**.
-
L’hidrogen (H), el liti (Li) i el sodi (Na), com a elements del grup 1, tenen només un electró a la capa exterior. Són inestables com a àtoms individuals, però poden estabilitzar-se en perdre o compartir un electró de valència.
Si aquests elements perden completament un electró — com fan normalment el Li i el Na — es converteixen en ions de càrrega positiva: Li+ i Na+.
-
El fluor (F) i el clor (Cl), com a elements del grup 17, tenen set electrons a la capa exterior. Tendeixen a assolir un octet estable en prendre un electró d’altres àtoms i es converteixen en ions amb càrrega negativa: F− i Cl−.
-
El carboni (C), com un element del grup 14, té
4electrons a la capa exterior. Això vol dir que li interessa agafar 4 electrons més per complir la regla de l’octet. -
L’Oxigen (O), amb 6 electrons, necessita 2 més i no para fins trobar-los. És molt habitual que trobo 2 electrons d’Hidrogen per formar l’H₂O (aigua).
Aleshores, les columnes de la taula periòdica reflecteixen el nombre d’electrons que es troben a la capa de valència de cada element, la qual cosa al seu torn determina com reaccionarà.
València química: és el nombre d’enllaços que l’àtom pot formar per aconseguir una capa externa completa (l’octet).
L’oxigen té 6 electrons a la seva capa externa i necessita 2 més per completar els 8.
Per això la valència química de l’oxigen és 2 (ex.: en H₂O, cada oxigen fa 2 enllaços amb hidrogen).
💡 Resum col·loquial: els electrons de valència són els que ja tens, la valència és quants et falten per ser feliç.
Exercicis
1. Quines són les 3 partícules subatòmiques presents a la majora dels elements? Quin és l’únic element que només té 2 partícules subatòmiques?
Com indiquen els apunts:
La majoria dels àtoms tenen aquests tres tipus de partícules subatòmiques, protons, electrons i neutrons.
L’hidrogen (H) és una excepció perquè generalment té un protó i un electró, però no té neutrons.
2. Cerca a la taula periòdica: la posició (nombre atòmic), l’abreviatura, la massa atòmica, i el grup al qual pertanyen els elements: Liti, Heli, Nitrogen.
| Element | Símbol | Posició (Núm. Atòmic) | Massa atòmica (u) | Grup de la Taula Periòdica |
|---|---|---|---|---|
| Element | Símbol | Posició (Núm. Atòmic) | Massa atòmica (u) | Grup de la Taula Periòdica |
|---|---|---|---|---|
| Liti | Li | 3 | 6.94 | Metalls alcalins (Grup 1) |
| Heli | He | 2 | 4.0026 | Gasos nobles (Grup 18) |
| Nitrogen | N | 7 | 14.007 | No metalls / Grup 15 (pnictògens) |
📌 Algunes curiositats:
- 🧪 Liti s’utilitza en bateries, però també té usos en medicina.
- 🌌 Heli és el segon element més abundant de l’univers (després de l’hidrogen).
- 💨 Nitrogen és el gas majoritari de l’atmosfera terrestre (78%!).
3. Tenint en compte la regla de l’octet i la valència dels següents elements, quin d’aquests és més estable. I quin és més “promiscu” (demana més electrons).
-
Els gasos nobles (He, Ne, Ar) tenen la capa completa → són tranquils i poc sociables.
-
Altres, en canvi, són més “promiscus”:
- Hidrogen (H) → només té 1 electró, sempre buscant parella.
- Carboni (C) → té 4 electrons externs, li encanta fer amistats múltiples (fins a 4 enllaços!).
- Oxigen (O) → amb 6 electrons, necessita 2 més i no para fins trobar-los.
- Nitrogen (N) → amb 5 electrons, vol 3 més i forma tríos químics sense complexos.
Activitat.
Cerca a la taula periòdica i altres fonts quines són les propietats (grup, massa atòmica, aplicacions a la vida…) dels 4 àtoms més comuns en els organismes vius.
Representa-les en un full de càlcul o una pàgina web amb HTML i CSS.
Segur que pots tu sól! A l’exercici anterior ja has trobat moltes propietats del Nitrogen.
I és una bona pregunta d’examen 🤔 …
Subcapes i orbitals
El model de Bohr és útil per explicar la reactivitat i la formació d’enllaços de molts elements, però en realitat, no dona una descripció gaire precisa de com estan distribuïts els electrons a l’espai al voltant del nucli.
Específicament, els electrons no circumden el nucli, sinó que passen la major part del seu temps a regions de l’espai que de vegades tenen formes complicades al voltant del nucli anomenades orbitals electrònics.
Realment no podem saber on és un electró en qualsevol moment donat, però podem determinar matemàticament el volum d’espai en què és més probable trobar-lo, diguem-ne, el volum d’espai on passa el 90% del seu temps. Aquesta regió d’alta probabilitat és allò que conforma un orbital i cada orbital pot contenir fins a dos electrons.
En aquesta página web pots veure mapes en 3D d’aquests volums: https://www.falstad.com/qmatom/
Les subcapes es designen amb les lletres s, p, d i f, i cadascuna indica una manera diferent. Per exemple, les subcapes s tenen un únic orbital esfèric, mentre que les p tenen tres orbitals en forma de manuella amb angles rectes entre ells.
La major part de la química orgànica, la química dels compostos que contenen carboni i que són fonamentals per a la biologia, tracta sobre interaccions entre electrons de les capes s i p, així que aquestes són les capes amb què cal familiaritzar-se. No obstant això, els àtoms amb molts electrons poden distribuir-ne alguns a les subcapes d i f. Les subcapes d i **f tenen formes més complexes i contenen cinc i set orbitals, respectivament.
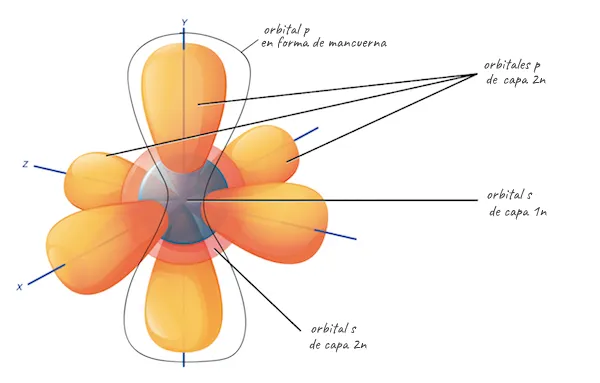
Configuració d’electrons per capes i orbitals
1️⃣ Primera capa (1n)
-
Conté un únic orbital: 1s (esfèric i molt proper al nucli).
-
Ompliment:
- Hidrogen (H): 1 electró → 1s¹
- Heli (He): 2 electrons → 1s²
-
Característiques:
- És la capa més interna.
- H i He són els únics elements amb electrons només a 1s.
- Primera fila de la taula periòdica → només tenen electrons a la 1n.
2️⃣ Segona capa (2n)
-
Conté:
- Un orbital 2s (esfèric)
- Tres orbitals 2p (en forma de “manuelles”), cada un amb capacitat per 2 electrons → màxim 6 electrons en total a 2p.
-
Ompliment:
- 2s es completa primer.
- 2p s’omple després.
-
Exemples:
-
Liti (Li): 3 electrons → 1s² 2s¹
-
Neó (Ne): 10 electrons → 1s² 2s² 2p⁶
- Segona capa completa → àtom estable, poc reactiu.
-
-
Segona fila de la taula periòdica → electrons distribuïts entre 1n i 2n.
3️⃣ Tercera capa (3n)
-
Conté:
- Orbital 3s (esfèric)
- Tres orbitals 3p (màxim 6 electrons)
- Orbital 3d (energia més alta; no es comença a omplir fins a la quarta fila)
-
Ompliment:
- 3s → 3p → 3d (després, a partir de la quarta fila)
-
Exemple:
- Argó (Ar): capa 3n amb 8 electrons de valència → estable encara que 3d encara no s’ompli
-
Característica clau:
- Els elements de la tercera fila poden ser estables amb només 8 electrons de valència, perquè les subcapes s i p estan completes.
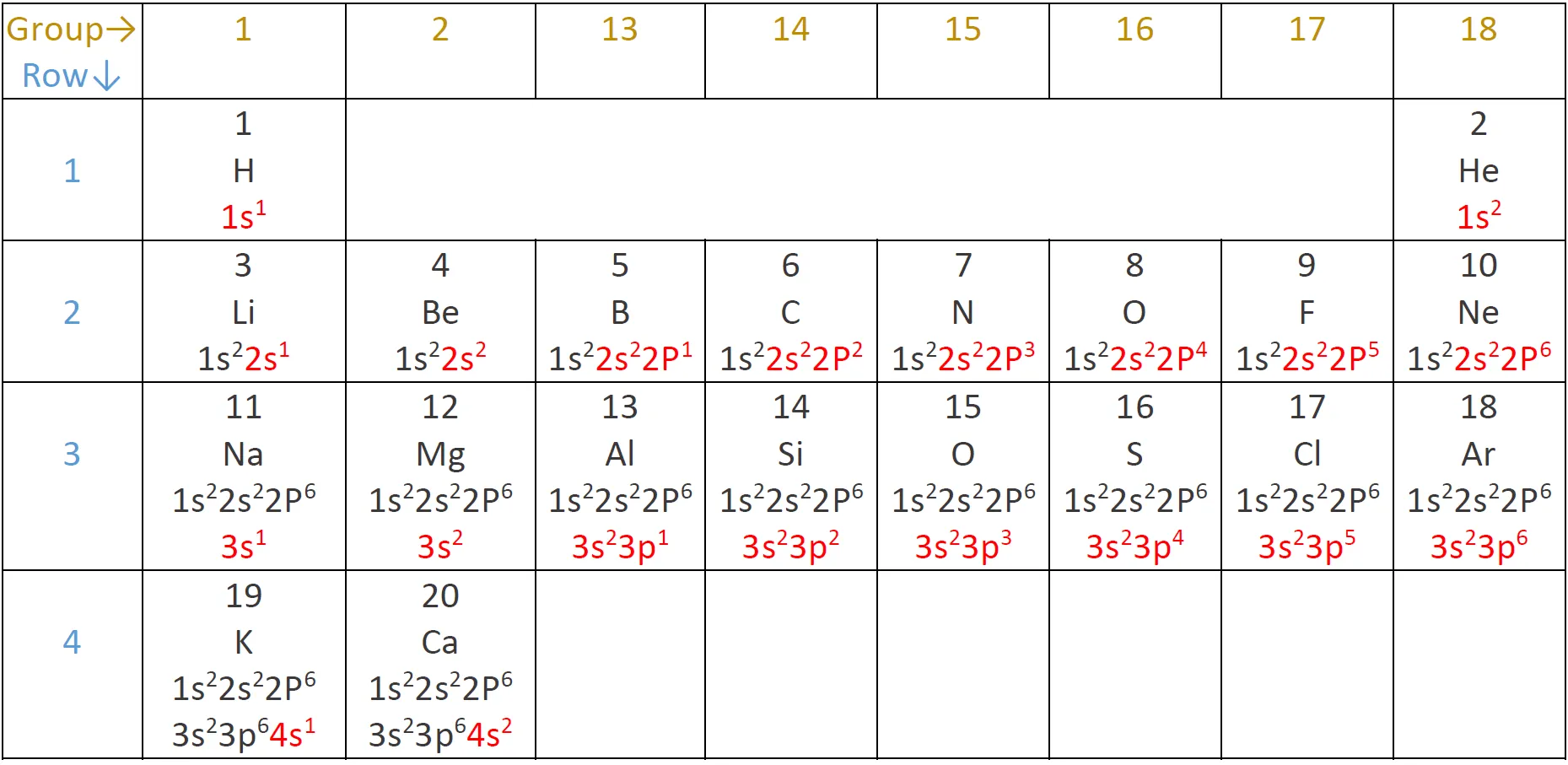
Com estan formats els orbitals en els primeres elements de la taula periòdica, els més presents al planeta Terra i als éssers viuss
Tot i que les capes d’electrons i els orbitals estan estretament relacionats, els orbitals proporcionen una imatge més precisa de la configuració electrònica d’un àtom.
Això és perquè els orbitals realment especifiquen la forma i la posició de les regions de l’espai que ocupen els electrons.
Isòtops.
Els isòtops són versions del mateix element que tenen el mateix nombre de protons (això defineix l’element), però diferent nombre de neutrons. Això fa que tinguin una massa diferent, però gairebé el mateix comportament químic.
Per exemple, el carboni (C) té 15 isòtops (però només 3 ocorren de forma natural):
print(pt.C.isotopes)[8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22]Amb pt pots obtenir informació sobre un isòtop específic:
isotope = pt.C[12]print(f"mass: {isotope.mass:.2f}, abundance: {isotope._abundance:.2f}")mass: 12.00, abundance: 98.94Crea un script que mostri els isòtops de l’oxigen (O), amb la seva massa i abundància relativa.
for number in pt.H.isotopes: isotope = pt.H[number] print(f"{number}: {isotope.mass:.2f}, {isotope._abundance_unc:.2f}")1: 1.01, 0.012: 2.01, 0.013: 3.02, 0.004: 4.03, 0.005: 5.04, 0.006: 6.04, 0.00carboni
De lluny, l’isòtop més comú del carboni és el carboni-12 (12C), que conté sis neutrons a més dels seus sis protons. La gran majoria de tot el carboni que es troba a la Terra és 12C. Gairebé el 99% de tot el carboni a la Terra és d’aquesta forma.
El següent isòtop de carboni més pesat, el carboni-13 (13C), té set neutrons. Només aproximadament l’1% de tot el carboni a la Terra és de la forma isotòpica 13C.
Tant el 12C com el 13C s’anomenen isòtops estables ja que no es descomponen en altres formes o elements amb el temps.
L’estrany isòtop de carboni-14 (14C) conté vuit neutrons al seu nucli. A diferència del 12C i el 13C, aquest isòtop és inestable, o radioactiu. El 14C és encara molt més rar. Només un de cada bilió d’àtoms de carboni és 14C.
Amb el temps, un àtom de 14C es descompondrà en un producte estable.
La datació per radiocarboni (14C) és un mètode de datació aplicable universalment en arqueologia i en ciències ambientals i geociències. El mètode es pot aplicar a una varietat de materials orgànics per a determinacions d’edat de fins a 50.000 anys abans del present.
Atorvi
atorvi és un paquet de Python per visualitzar orbitals atòmics individuals i les seves diverses combinacions lineals.
En aquest document tens el manual: Atorvi - Manual
En aquest carpeta tens orbitals generats amb atorvi: https://github.com/dkorotin/atorvi/tree/main/examples/orbitals
Entorn de treball
Afegeix una dependència amb la biblioteca atorvi al projecte:
uv add atorviLa biblioteca genera els orbitals atòmics sol·licitats en una malla 3D i els exporta, juntament amb l’estructura cristal·lina introduïda (molècula o cristall periòdic), en un fitxer en [format XCrysDen .xsf](http://www.xcrysden.org/doc/XSF.html.
Per tant, has d’instal·lar un visutalitzador 3D per visualitzar els orbitals codificats en el fitxer .xsf.
Vesta és un programa de visualització 3D per a models estructurals, dades volumètriques com ara densitats electròniques/nuclears, i morfologies cristal·lines.
Obre una sessió de Powershell
Instal·la el visualitzador Vesta amb Windows - Scoop:
scoop bucket add extrasscoop install vestaorbital.py
Crea el fitxer orbital.py amb aquest contingut:
import atorviimport os
file = atorvi.OrbitalFile("orbital.xsf")
# Edita ..
# Orbital for an Ni atom (Z = 28)orbital = "d_{3z^2-r^2}"file.add_orbital(orbital, position=[0, 0, 0], znumber=28)
## ... fins aquí
file.write_data()
path = os.path.expanduser("~/scoop/apps/vesta/current/VESTA.exe")os.system(f"{path} orbital.xsf")Executa l’script.
Pots veure el resultat amb el visualitzador Vesta:
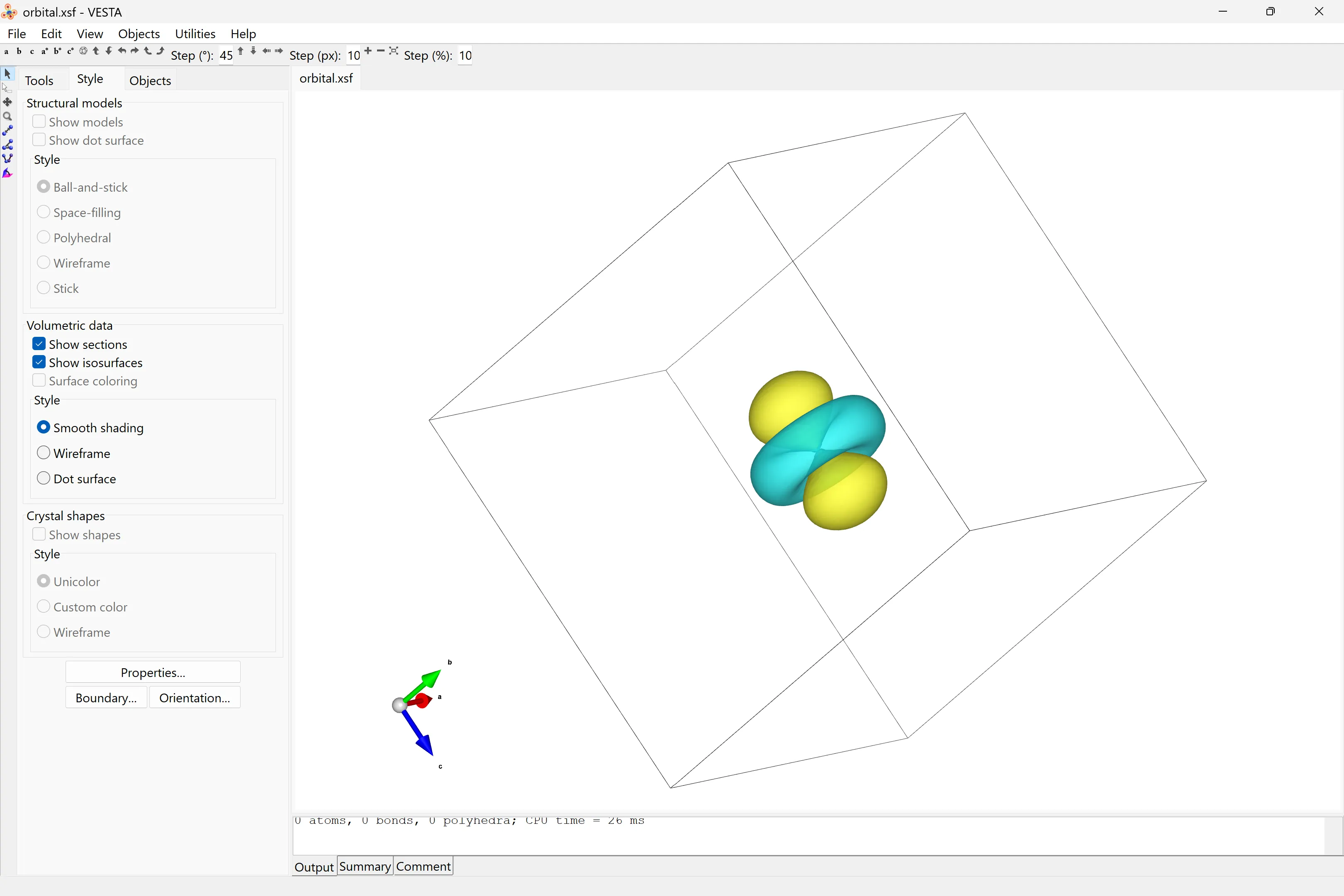
Modifica el valor de la variable orbital per visualitzar altres orbitals.
The orbitals available for generation are:
print(atorvi.supported_orbitals)Fixa’t amb el paràmetre znumber, que passes a la funció addorbital(orbital,position,znumber) i dedueix què diries que és:
file.add_orbital(orbital, position=[0, 0, 0], znumber=28)