Els quatre elements comuns a tots els organismes vius són l'oxigen (O), el carboni (C), l'hidrogen (H) i el nitrogen (N), que en conjunt formen al voltant del 96% del cos humà. Aquests elements s'uneixen formant molècules mitjançant enllaços químics.
On this page
Introducció
Els àtoms i molècules segueixen les regles de la química i la física tot i que formen part d’un organisme. Alguns àtoms tendeixen a guanyar o perdre electrons, o formar enllaços entre ells, i això segueix sent cert fins i tot quan els àtoms o molècules formen part d’un organisme viu.
De fet, les interaccions senzilles entre àtoms – dutes a terme moltes vegades i en moltes combinacions diferents en una cèl·lula individual o en un organisme més gran – són les que fan possible la vida.
Si dos àtoms tenen patrons d’electrons complementaris, poden reaccionar i formar un enllaç químic, la qual cosa crea una molècula o un compost.
Exemples de compostos i mol·lecules.
Una molècula és una unitat formada per dos o més àtoms units mitjançant enllaços covalents (com una parella que es dona la mà 👋👋).
Pot ser d’un sol element com el O₂ (oxigen molecular)
Oxygen 977
O de diferents elements com el CH₄ (metà)
Metà
Un compost químic (compund en anglès) és qualsevol substància formada per dos o més elements químics combinats en proporcions fixes.
Ara bé… no tots els compostos són molècules.
✅ Compostos mol·leculars:
H₂O (aigua) formada per àtoms d’hidrogen i oxigen.
Water 962
CO₂ (diòxid de carboni) dues molècules d’oxigen amb una de carboni.
Carbon Dioxide 280
❌ No són molècules, però sí compostos:
NaCl (sal de taula) està format per ions de sodi i clor units per enllaços iònics.
Sodium Chloride 5234
Ara toca entendre com funcionen els enllaços entre elements, fonamentals per a la vida.
Els ions i els enllaços iònics
Alguns àtoms es tornen més estables en guanyar o perdre un electró complet (o diversos electrons). Quan ho fan, els àtoms formen ions, o partícules carregades. El guanyar o perdre electrons pot donar a un àtom una capa electrònica externa plena i fer que sigui energèticament més estable.
La formació d’ions
Els ions poden ser de dos tipus: Cations i anions.
Els cations són àtoms que perden electrons i queden amb càrrega positiva (ex.: Na → Na⁺).
Els anions són àtoms que guanyen electrons i queden amb càrrega negativa; els seus noms acaben en “-ur” (ex.: Cl⁻ → clorur).
Quan un àtom perd electrons i un altre els guanya, es produeix una transferència d’electrons, com passa entre el sodi i el clor per formar el clorur de sodi (NaCl).
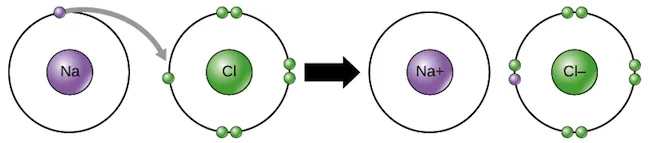
El sodi transfereix un dels seus electrons de valència al clor, cosa que resulta en la formació d’un ió sodi (que no té electrons a la tercera capa, cosa que significa que la seva segona capa està completa) i un ió clorur (amb vuit electrons a la seva tercera capa, cosa que li dona un octet estable).
En general, un àtom ha de perdre un electró alhora que un altre àtom guanya un electró +1 (Na+) o –1 (Cl−).
Perquè un àtom de sodi (Na) perdi un electró, necessita tenir un receptor adequat com un àtom de clor (Cl) per complir la regla de l’octet, per a què els 2 elements tinguin equilibri.
Per exemple, els ions sodi carregats positivament i els ions clorur carregats negativament s’atreuen entre si per formar clorur de sodi o sal de taula.
Moltes begudes esportives i suplements dietètics proporcionen ions per reposar els que es perden durant l’exercici per la sudoració.
Enllaços covalents
Una altra manera com els àtoms es tornen més estables és en compartir electrons (en lloc de guanyar-los o perdre’ls completament), formant així enllaços covalents.
Aquests enllaços són més comuns que els enllaços iònics a les molècules dels organismes vius.
Per exemple, els enllaços covalents són clau per a l’estructura de les molècules orgàniques basades en el carboni, com el nostre ADN i les proteïnes.
També hi ha enllaços covalents en molècules inorgàniques més petites, com ara H2O, CO2, i O2.
Es poden compartir un, dos o tres parells d’electrons, cosa que resulta en enllaços simples, dobles o triples, respectivament. Com més electrons comparteixin dos àtoms, més fort serà l’enllaç.
Hi ha dos tipus principals d’enllaços covalents: polar i no polar.
Enllaços covalents polars
En un enllaç covalent polar, els electrons es comparteixen de manera no equitativa entre els àtoms i passen més temps a prop d’un àtom que de l’altre.
Com a exemple d’enllaç covalent polar, examinem l’aigua:
Una sola molècula d‟aigua, H2O, està formada per àtoms d’hidrogen units a un àtom d’oxigen.
Cada hidrogen comparteix un electró amb l’oxigen, i l’oxigen comparteix un dels seus amb cada hidrogen:
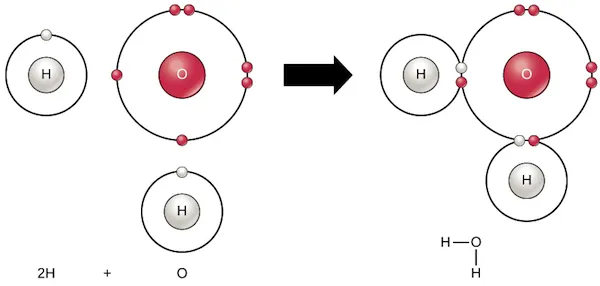
Això crea dos enllaços covalents polars. Els electrons compartits passen més temps prop de l’oxigen, i això fa que:
- l’oxigen tingui una càrrega parcialment negativa (δ⁻)
- i cada hidrogen, una càrrega parcialment positiva (δ⁺)
Aquesta distribució desigual de càrregues dona a l’aigua la seva polaritat i explica moltes de les seves propietats màgiques — com la seva capacitat d’unir-se, dissoldre substàncies i donar vida. 🌍✨
Enllaços covalents no polars
-
Es formen entre àtoms iguals o amb electronegativitats similars.
-
Exemples:
- O₂ → els dos àtoms d’oxigen comparteixen electrons equitativament.
- CH₄ (metà) → el carboni i els hidrògens tenen electronegativitats semblants, per això els enllaços C–H són no polars.
⚡ Polaritat dels enllaços
- La polaritat d’un enllaç depèn de la diferència d’electronegativitat entre els àtoms.
- Si un àtom és molt més electronegatiu que l’altre → enllaç polar.
- Si comparteixen electrons de manera equitativa → enllaç no polar.
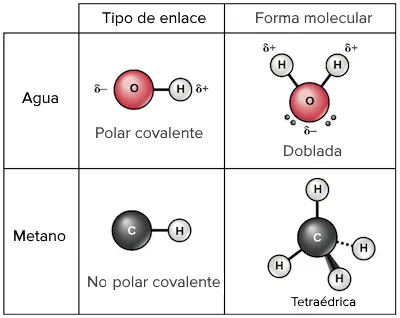
Taula que mostra l’aigua i el metà com a exemples de molècules amb enllaços polars i no polars, respectivament
Enllaços febles en biologia i química
Els enllaços covalents i iònics són forts —formen l’esquelet de les molècules. Però també hi ha enllaços febles, més temporals i dinàmics, que ajuden a mantenir la forma i funció de les biomolècules.
💧 1. Ponts d’hidrogen
- Definició: Es formen entre un H unit a un àtom electronegatiu (O, N, F) i un altre àtom electronegatiu proper.
- Exemple 1: Entre molècules d’aigua → H₂O···H₂O
- Exemple 2: Entre bases de l’ADN → Adenina···Timina (2 ponts), Guanina···Citosina (3 ponts)
- Funció: Estabilitzen estructures i proporcionen cohesió sense ser rígids.
Els enllaços d’hidrogen proporcionen moltes de les propietats de l’aigua que sostenen la vida, i estabilitzen les estructures de les proteïnes i l’ADN, tots dos ingredients clau de les cèl·lules.
⚡ 2. Forces de Van der Waals
Les forces de Van der Waals, també conegudes com a forces de dispersió de London, són atraccions molt dèbils causades per càrregues temporals d’electrons en àtoms o molècules.
- Exemple 1: Interacció entre molècules de gas no polar, com N₂ o O₂
- Exemple 2: Manté membranes cel·lulars unides (interaccions entre cadenes hidrocarbonades)
- Funció: Contribueixen a la forma i compactació de molècules en biologia.
En bioinformàtica ens interessen especialment els enllaços febles, com els enllaços d’hidrogen. Tot i ser temporals i delicats, són els que donen estabilitat i forma a l’aigua, a les proteïnes i a l’ADN. Sense ells, les molècules essencials de la vida no podrien plegar-se, reconèixer-se ni interactuar.
El que és realment sorprenent és pensar que milers de milions d’aquestes interaccions d’enllaços químics, forts i febles, estables i temporals, estan passant en els nostres cossos ara mateix, i ens mantenen units com un tot i funcionant!
Representar enllaços: fórmula de Lewis
La 🧪 fórmula de Lewis, també anomenada esquema de linies, ens permet veure els àtoms que estan units i amb quin tipus d’enllaç (simple, doble, triple).
Exemple: H₂O → H–O–H
Sabem que l’oxigen està al centre i els hidrogens als costats.
Això és exactament la informació que un ordinador necessita per generar una estructura, en formats com SMILES i programes com RDKit.
Per això s’estudia als instituts.
🔹 Exemple resolt: CH₃OH (metanol)
Dibuix esquemàtic:
H |H – C – O – H | HAnàlisi:
| Propietat | Nombre / Observació |
|---|---|
| Enllaços polars | 2 (C–O i O–H) |
| Enllaços no polars | 3 (C–H) |
| H implícits | 3 |
Comentari:
- Els enllaços polars apareixen on un àtom és molt més electronegatiu que l’altre.
- Els H implícits són aquells que no cal escriure, però existeixen per complir la valència dels àtoms.
Exercicis
Dibuixa la molècula i compta: enllaços polars i no polars dels següents compostos:
-
H₂O (aigua)
Dibuix esquemàtic:
H – O – HEnllaços polars: 2
Enllaços no polars: 0
-
CH₄ (metà)
Dibuix esquemàtic:
H|H – C – H|HEnllaços polars: 0
Enllaços no polars: 4
-
NH₃ (amoníac)
Dibuix esquemàtic:
H|H – N|HEnllaços polars: 3
Enllaços no polars: 0
-
CO₂ (diòxid de carboni)
Dibuix esquemàtic:
O=C=OEnllaços polars: 2
Enllaços no polars: 0
Fixa’t que es tracta d’un enllaç doble, per això el representem amb
=
La massa atòmica de l’aigua (i de qualsevol compost) és la suma de la massa dels elements que conté:
>>> from periodictable import H, O>>> O.mass15.999>>> 2 * H.mass + O.mass18.015>>> f"Water mass: {2 * H.mass + O.mass}"'Water mass: 18.015'Calcula la massa del CO2.
>>> pt.C.mass + pt.O.mass28.009999999999998Surt de la sessió interactiva.