Una proteïna està formada per una o més cadenes lineals d'aminoàcids, cadascuna de les quals s'anomena polipèptid.
On this page
Introduction
At first glance, most proteins look like chaotic crowding of atoms.
A closer look, however, reveals complex structures organized hierarchically:
-
Proteins are made up of one or more linear chains of amino acids, each of which is called polypeptide.
-
Each polypeptide chain folds into a specific three-dimensional shape that is essential to the protein’s function.
The folding process and the resulting structure can be understood in terms of four hierarchical levels: primary, secondary, tertiary, and quaternary structures.
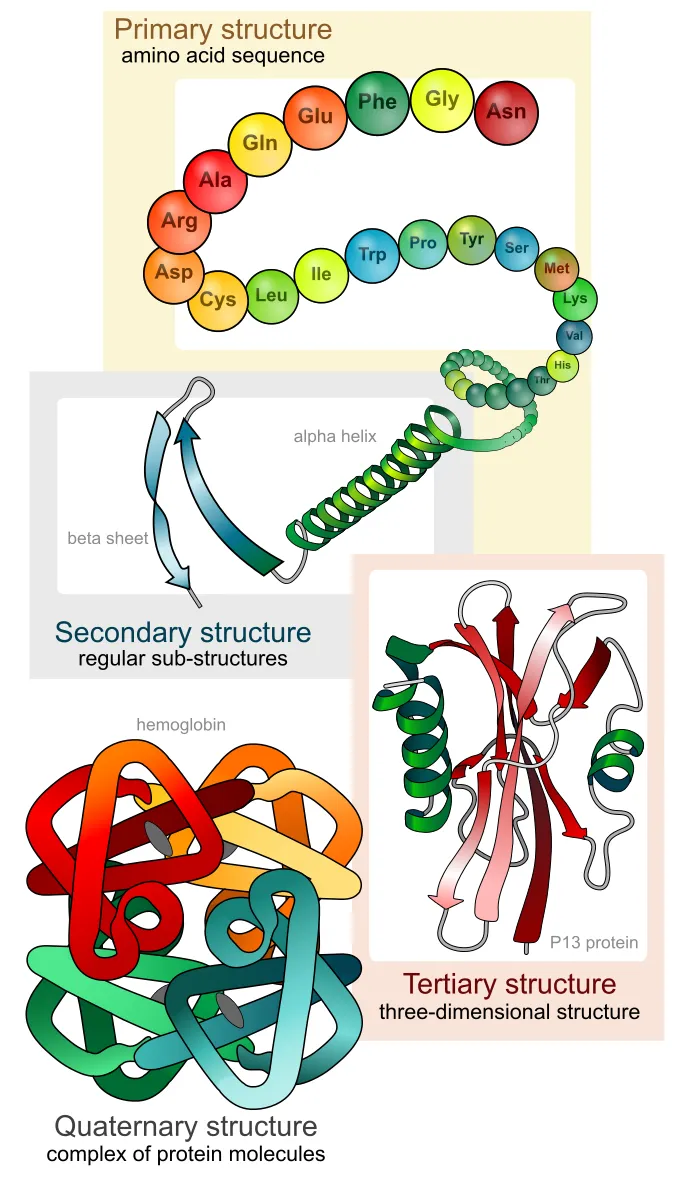
Primary structure
The first level of this hierarchy, referred to as the ‘primary structure’, is the ordered sequence of amino acids composing the protein chain.
Secondary structure
Certain segments within this chain tend to fold into simple shapes, such as helices, loops, etc. These structures are referred to as ‘secondary elements’, and collectively constitute the second level of the protein hierarchy, the secondary structure. Secondary elements are local and (except for loops) proceed along one axis of the protein chain.
Tertiary structure
The overall chain tends to fold further into a compact, three-dimensional tertiary structure, which constitutes the third level of the hierarchy.
The tertiary structure is the most stable form of the protein, since it optimizes the various attraction forces among the different amino acids that compose the chain.
Moreover, the tertiary structure is also the biologically active form of the protein, and its disruption renders the protein partially or completely inactive. Therefore, the tertiary structure is often referred to as the ‘native structure’ of the protein.
Quaternary structure
The third hierarchical level of structure may be common to most proteins, but it is not necessarily the final level. Some proteins include more than one chain. In such cases, each chain folds separately into a tertiary structure and then joins the others to form a biologically active complex. This type of organization constitutes the fourth level of structural hierarchy and is referred to as ‘quaternary structure.’
It is important to distinguish between the quaternary structure and complexes that form when cellular proteins interact physically with other members of their biochemical pathways. Such temporary complexes are not considered to be quaternary structures, since the individual proteins composing them are also active when separated.
Protein Strucure and Folding
Primary structure
The primary structure of a protein is the exact ordering (i.e., sequence) of the amino acids that form its chain. The exact sequence of the protein is crucial, as it determines the final fold, and therefore the function, of the protein.
L’estructura primària és el nivell més senzill d’estructura d’una proteïna, i consisteix en la seqüència d’aminoàcids d’una cadena polipeptídica.
Insulina
Per exemple, l’hormona insulina té dues cadenes polipeptídiques, A i B.
A continuació tens un diagrama d’una molècula d’insulina de vaca, que té una estructura semblant a la d’una persona:
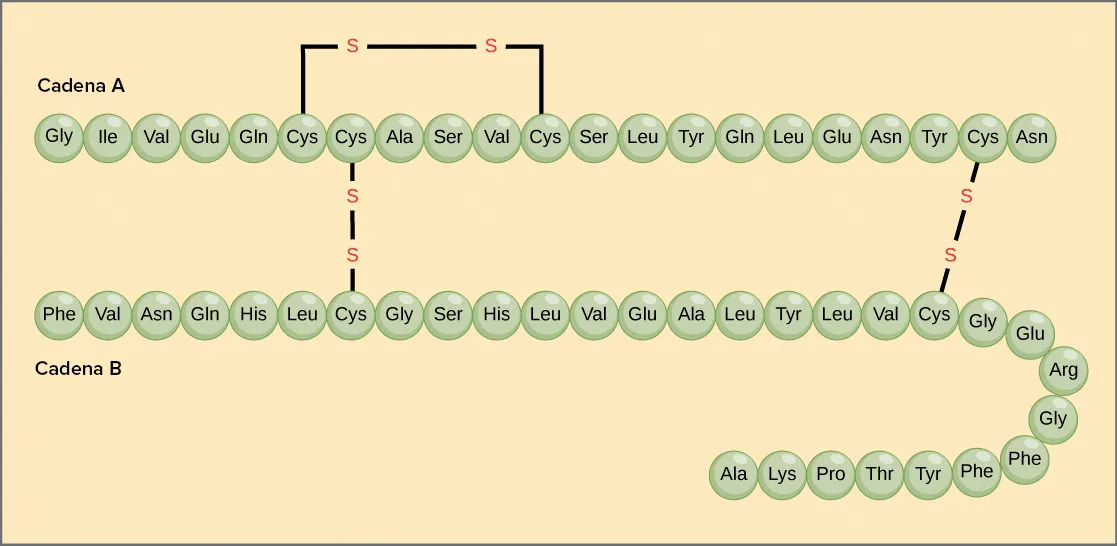
Els aminoàcids que componen cada cadena d’insulina estan representats com a cercles connectats, cadascun amb l’abreviatura de tres lletres del nom.
Cada cadena té el seu conjunt d’aminoàcids, ensamblats en un ordre determinat. Per exemple, la seqüència de la cadena A comença amb una glicina a l’extrem N-terminal i acaba amb una asparagina a l’extrem C-terminal i és diferent de la seqüència de la cadena B.
La imatge també mostra com les dues cadenes estan connectades entre si per ponts disulfur (enllaços sofre-sofre entre cisteïnes) que donen forma a l’estructura quaternària.
La cadena A també conté un enllaç disulfur intern que dona forma a l’estructura terciària.
Hemoglobina
L’ADN del gen que codifica una proteïna (o que en codifica una part en el cas d’una proteïna amb diverses subunitats) determina la seqüència d’aminoàcids de la proteïna.
Un canvi a la seqüència d’ADN del gen pot modificar la seqüència d’aminoàcids de la proteïna.
Fins i tot, canviar tan sols un aminoàcid en la seqüència d’una proteïna pot afectar-ne l’estructura i la funció general.
L’hemoglobina (els glòbuls vermells) és la proteïna que transporta oxigen a la sang.
L’anèmia falciforme és una malaltia hereditària en que l’ADN que codifica la hemoglobina té un únic error en la codificació del sisé aminoàcid de la cadena β de l’hemoglobina (un dels dos tipus de cadenes de proteïnes que conformen l’hemoglobina).
Tal com es mostra a continuació, l’àcid glutamàtic és reemplaçat per una valina:
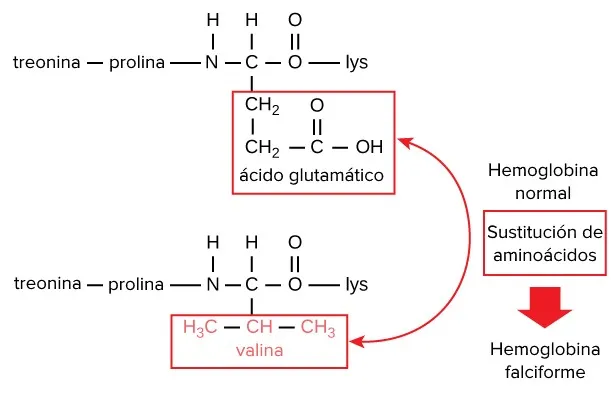
Una persona el cos de la qual només produeix hemoglobina de cèl·lules falciformes tindrà símptomes d’anèmia falciforme.
Això passa perquè el canvi d’aminoàcids d’àcid gultamàtic a valina provoca que les molècules d’hemoglobina s’acoblin en fibres llargues, i aquestes fibres deformen els glòbuls vermells en forma de disc a una de mitja lluna:
Tal com pots veure en el vide, es cèl·lules falciformes s’atoren en tractar de passar a través dels vasos sanguinis.
Aquest deteriorament en el flux sanguini ocasiona greus problemes de salut, com ara dispnea, marejos, i mal de cap i abdominal.
El més extraordinari és que una molècula d’hemoglobina està composta per dues cadenes α i dues cadenes β, cadascuna amb al voltant de 150 aminoàcids, que arriben a un total aproximat de 600 en tota la proteïna.
La diferència entre una molècula d’hemoglobina normal i una molècula de cèl·lula falciforme és de només 2 aminoàcids dels aproximadament 600.
Estructura secundària
L’estructura secundària d’una proteïna fa referència a estructures plegades localment que es formen dins d’un polipèptid a causa de les interaccions entre els àtoms de l’esquelet.
L’esquelet només es refereix a la cadena polipeptídica, deixant a part els grups R, cosa que significa que l’estructura secundària no implica els àtoms dels grups R.
Els tipus d’estructures secundàries més comunes són l’hèlix-α i el full o la làmina plegada β.
Moltes proteïnes contenen tant hèlixs α com làmines β, encara que algunes presenten només un tipus d’estructura secundària (o no en formen cap).
Tant les hèlixs α com les làmines β mantenen la forma mitjançant ponts d’hidrogen, que es formen entre l’O del grup carbonil d’un aminoàcid i l’H del grup amino d’un altre tal com pots veure en aquest dibuix:
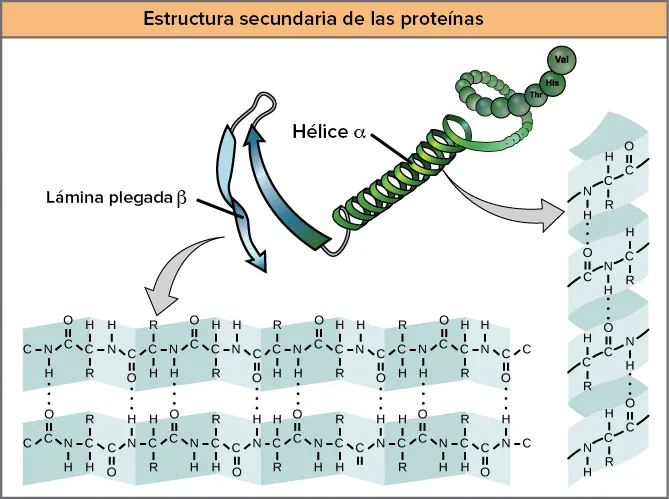
Hèlix α
En una hèlix α, el grup carbonil (C=O) d’un aminoàcid s’uneix mitjançant un pont d’hidrogen al grup amino H (N-H) d’un altre aminoàcid que està quatre llocs més endavant a la cadena.
Per exemple, el carbonil de l’aminoàcid 1 forma un pont d’hidrogen amb l’N-H de l’aminoàcid 5.
Aquest patró d’enllaç jala la cadena polipeptídica per formar una estructura helicoïdal que s’assembla a un llistó arrissat, en què cada volta d’hèlix conté 3.6 aminoàcids.
Els grups R dels aminoàcids sobresurten cap a fora de l’hèlix α, on poden interactuar lliurement.
Làmina β
En una làmina β, dos segments o més d’una cadena polipeptídica s’alineen l’un al costat de l’altre, formant una estructura laminar que es manté unida per ponts d’hidrogen.
Aquests ponts es formen entre els grups carbonil i amino de l’esquelet, mentre que els grups R s’estenen per dalt i per sota del pla de la fulla.
Les cadenes d’una làmina β poden ser paral·leles en apuntar en la mateixa direcció (els seus extrems N-terminal i C-terminal s’emparellen amb els de l’altra cadena) o antiparal·leles en apuntar en adreces oposades (l’extrem N-terminal d’una cadena és al costat de l’extrem C-terminal de l’altra cadena).
Aminoàcids
Certs aminoàcids són més o menys propensos a trobar-se a les hèlixs α o les ganivetes β.
Per exemple, l’aminoàcid prolina de vegades s’anomena “interruptor de l’hèlix”, pel fet que el seu inusual grup R (que s’uneix al grup amino per formar un anell) crea una duplicitat a la cadena i no és compatible amb la formació de l’hèlix.
La prolina es troba normalment a les duplicitats, les regions no estructurades entre les estructures secundàries.
De la mateixa manera, els aminoàcids com el triptòfan, la tirosina i la fenilalanina, que tenen estructures anulars grans als seus grups R, es troben sovint a les làmines β, potser perquè l’estructura proporciona suficient espai per a les cadenes laterals.
Estructura terciària
L’estructura terciària és una estructura tridimensional que es genera principalment per les interaccions entre els grups R dels aminoàcids que conformen les proteïnes,
Les interaccions del grup R que contribueixen a l’estructura terciària inclouen tota la gamma d’enllaços no covalents: ponts d’hidrogen, enllaços iònics, interaccions dipol-dipol i forces de dispersió de London.
Per exemple:
-
Els grups R amb càrregues similars es repel·leixen entre si, mentre que aquells amb càrregues oposades poden formar un enllaç iònic.
-
Els grups R polars poden formar ponts d’hidrogen i altres tipus d’interaccions dipol-dipol.
Les interaccions hidrofòbiques també són importants per a l’estructura terciària, ja que els aminoàcids amb grups R no polars hidrofòbics s’agrupen junts a l’interior de la proteïna i deixen els aminoàcids hidrofílics a l’exterior per interactuar amb les molècules d’aigua circumdants.
Pont disulfur
Finalment, hi ha un tipus d’enllaç covalent especial que pot contribuir a l’estructura terciària: els ponts disulfur.
Aquests enllaços covalents, formats entre els sofres de les cadenes laterals de les cisteïnes, són molt més forts que els altres tipus d’enllaços que contribueixen a l’estructura terciària.
Actuen com a “passadors de seguretat” moleculars en mantenir totes les parts del polipèptid ben unides entre si.
Diagrama
A continuació tens una imatge d’una cadena polipeptídica hipotètica, que il·lustra diferents tipus d´interaccions de cadena lateral que poden contribuir a l’estructura terciària.
Aquests inclouen interaccions hidrofòbiques, enllaços iònics, ponts d’hidrogen i formació de ponts disulfur:
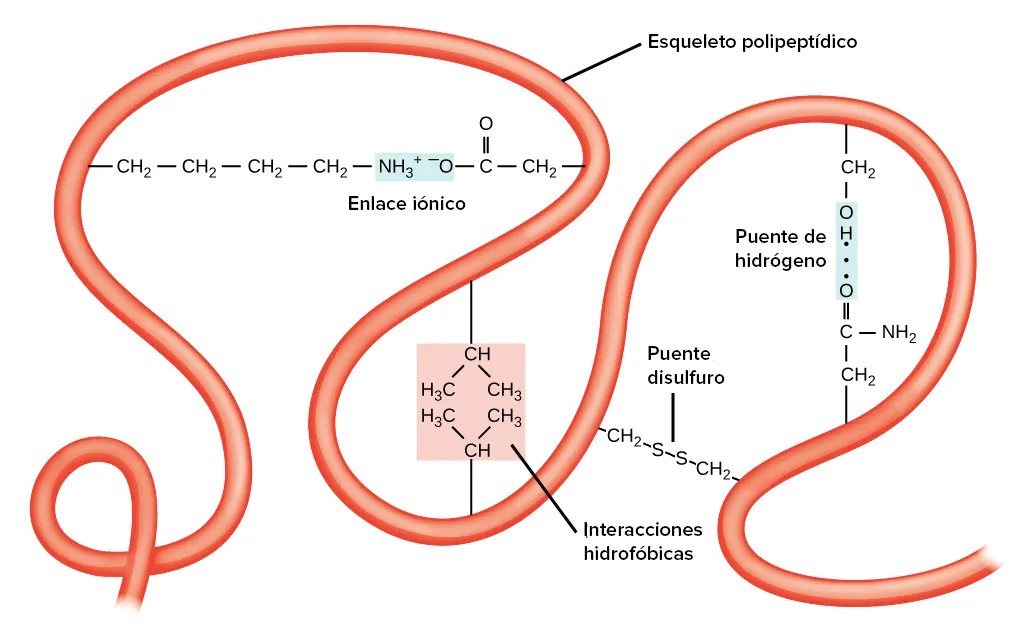
Estructura quaternària
Algunes proteïnes es componen de diverses cadenes polipeptídiques, també conegudes com a subunitats.
L’estructura quaternària d’una proteïna és crea a partir de l’unió d’aquestes subunitats.
Tal com hem vist abans, un exemple de proteïna amb estructura quaternària és l’hemoglobina, que està formada per quatre subunitats, dues del tipus α i dues del tipus β.
Un altre exemple és l’ADN polimerasa, un enzim que sintetitza noves cadenes d’ADN que es compon de deu subunitats.
Quatre ordres de l’estructura
A continuació tens un diagrama de flux que representa els quatre ordres de l’estructura de la proteïna:
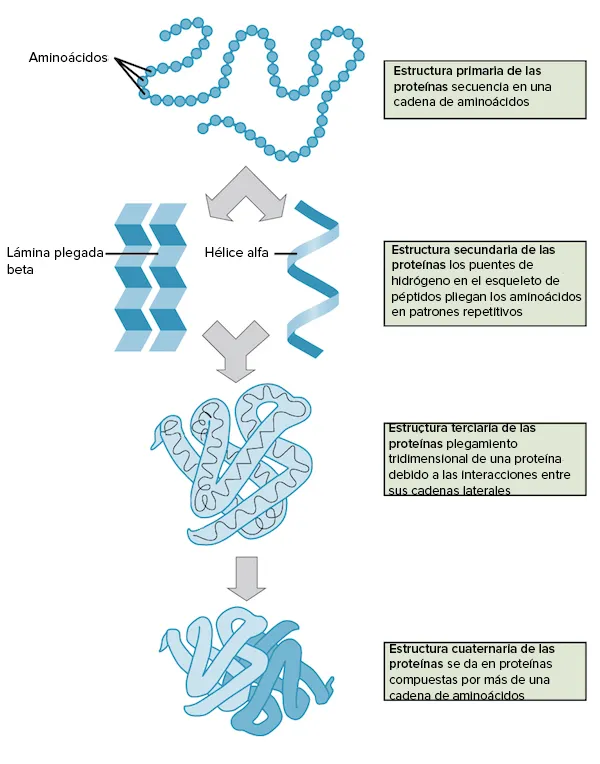
La desnaturalització i el plegament de la proteïna
Si es canvia la temperatura o el pH de l’entorn d’una proteïna o està exposada a substàncies químiques, aquestes interaccions poden alterar la forma única de la proteïna, provocant la pèrdua de l’estructura tridimensional de la proteïna i convertint-la en una cadena d’aminoàcids sense estructura.
Quan una proteïna perd la seva estructura de més ordre, però no la seqüència primària, es diu que ha estat desnaturalitzada i ja no és funcional.
En algunes proteïnes, la desnaturalització es pot revertir: atès que l’estructura primària del polipèptid segueix intacta (els aminoàcids no s’han separat), és possible que en recuperi la funcionalitat si torna al seu entorn normal.
Alguns investigadors han determinat que algunes proteïnes es poden tornar a plegar després la desnaturalització fins i tot en un tub d’assaig. Atès que aquestes proteïnes poden passar per si mateixes d’una manera no estructurada a una plegada, les seqüències d’aminoàcids han de contenir tota la informació necessària per al plegament.
En altres ocasions, però, la desnaturalització és permanent perquè no totes les proteïnes són capaces de fer-ho i la manera com es pleguen normalment en una cèl·lula sembla ser més complicat.
Moltes proteïnes no es pleguen per si mateixes, sinó que reben ajuda de proteïnes conegudes com a xaperones (chaperonines).
Clara d’ou
Un exemple de desnaturalització irreversible de la proteïna passa en fregir un ou.
La clara d’ou conté grans quantitats de proteïnes anomenades albúmines, i aquestes normalment tenen una forma tridimensional específica gràcies als enllaços que es formen entre els diferents aminoàcids.
La calor causa el trencament d’aquests enllaços i exposa els aminoàcids hidrofòbics (que odien l’aigua) que normalment són a l’interior de la proteïna.
Els aminoàcids hidrofòbics, en intentar evitar l’aigua que els envolta a la clara d’ou, s’enganxaran els uns amb els altres i formen una xarxa que dona estructura a la clara d’ou i la torna blanca i opaca.
La proteïna albúmina de la clara líquida no torna a la seva forma original crua fins i tot quan es refreda.